kategoriler: Öne Çıkan Makaleler » Acemi elektrikçiler
Görüntülenme sayısı: 36288
Makaleye Yorumlar: 1
Kimyasal akım kaynakları: ana özellikler
 İki yüzyıldan fazla bir süredir insanlık, doğru akım üretmek için çeşitli maddeler arasındaki kimyasal reaksiyonların enerjisini kullanmaktadır.
İki yüzyıldan fazla bir süredir insanlık, doğru akım üretmek için çeşitli maddeler arasındaki kimyasal reaksiyonların enerjisini kullanmaktadır.
Çalışma prensibi
Bir oksitleyici maddenin ve bir indirgeyici maddenin özelliklerine sahip maddeler arasında meydana gelen redoks reaksiyonuna, hareketi bir elektrik akımı oluşturan elektronların salınması eşlik eder. Bununla birlikte, enerjisini kullanmak için, elektronların harici bir devreden geçişi için koşullar yaratmak gerekir; aksi takdirde, bir oksitleyici ajan ve bir indirgeyici ajanın basit bir karışımından ısı ile salınır.
Bu nedenle, tüm kimyasal akım kaynaklarının iki elektrotu vardır:
-
üzerinde oksidasyonun meydana geldiği anot;
-
katot, maddenin restorasyonunu gerçekleştirir.
Uzaktaki elektrotlar, ortamın iyonlara ayrılma süreçleri nedeniyle elektrik akımı ileten bir madde olan bir elektrolit içeren bir kaba yerleştirilir.
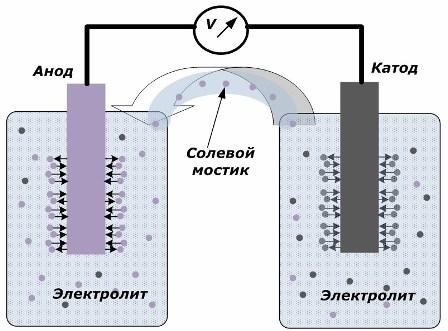
Kimyasal enerjiyi elektrik enerjisine dönüştürme ilkesi
Şekil, elektrotların, iç devre boyunca iyonların hareketinin yaratıldığı bir tuz köprüsü ile bağlanan ayrı kaplara yerleştirildiğini göstermektedir. Dış ve iç devreler açık olduğunda, elektrotlar üzerinde iki işlem gerçekleşir: iyonların elektrot metalinden elektrolite geçişi ve iyonların elektrolitten elektrotların kristal kafesine geçişi.
Bu işlemlerin akış hızları aynıdır ve her elektrotta zıt işaretlerin voltaj potansiyelleri birikir. Bir tuz köprüsünden bağlanırlar ve bir yük uygulanırsa, bir elektrik devresi meydana gelecektir. İç akım, elektrotlar arasındaki iyonların elektrolit ve tuz köprüsünden geçmesiyle oluşur. Elektronların dış devre boyunca anottan katoda doğru hareketi.
Hemen hemen tüm redoks reaksiyonlarına elektrik üretimi eşlik eder. Ancak değeri, kullanılan kimyasalların hacimleri ve kütleleri, elektrolit yapmak için kullanılan malzemeler, elektrolit, iyon konsantrasyonu, tasarım gibi birçok faktöre bağlıdır.
Modern kimyasal akım kaynaklarında en yaygın olarak kullanılanlar:
-
anot (indirgeyici ajan), çinko (Zn), kurşun (Pb), kadmiyum (Cd) ve diğer bazı metallerin malzemesi için;
-
katot malzemesi (oksitleyici) - kurşun oksit Pb02, manganez oksit Mn02, nikel hidroksit NiOOH ve diğerleri için;
-
asitler, alkaliler veya tuzların çözeltilerine dayanan elektrolitler.
Sınıflandırma Yöntemleri
Kimyasal güç kaynaklarının bir kısmı yeniden kullanılabilirken diğeri kullanılamaz. Bu ilke, sınıflandırmalarının temeli olarak kabul edilir.
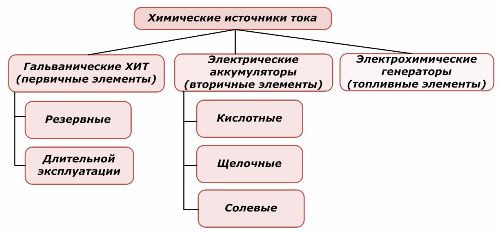
Kimyasal elementlerin sınıflandırılması
Elektromotor kuvvet galvanik hücreler, tasarıma bağlı olarak, 1.2 ÷ 1.5 volta ulaşır. Büyük değerler elde etmek için, piller halinde birleştirilir ve seri olarak bağlanırlar. Piller paralel bağlandığında, akım ve güç artar.
Genel olarak, birincil kimyasal akım kaynaklarının yeniden şarjı desteklemediği kabul edilir, ancak daha kesin olarak bu pozisyon farklı şekilde formüle edilebilir: uygulanması ekonomik olarak mümkün değildir.
Fazladan birincil kimyasal akım kaynakları, elektrolitin elektrotlardan izole edildiği bir durumda depolanır. Bu, redoks reaksiyonunun oluşumunu ortadan kaldırır ve işletmeye alınmaya hazır olmasını sağlar. Yeniden kullanılmazlar. Kimyasal yedek güç kaynaklarının raf ömrü 10-15 yıl ile sınırlıdır.
Piller, harici elektrik enerjisi uygulanarak başarıyla şarj edilir. Bu özellik nedeniyle bunlara ikincil akım kaynakları denir. Yüzlerce ve binlerce şarj-deşarj döngüsüne dayanabilirler.Akünün EMF'si 1,0 ÷ 1,5 volt aralığında olabilir. Ayrıca piller halinde birleştirilirler.
Elektrokimyasal jeneratörler galvanik hücreler prensibi üzerinde çalışır, ancak elektrokimyasal reaksiyonu gerçekleştirmek için maddeler dışarıdan gelir ve serbest bırakılan tüm ürünler elektrolitten çıkarılır. Bu, sürekli bir süreç düzenlemenizi sağlar.
Kimyasal güç kaynaklarının temel performans özellikleri
1. Açık terminaller arasındaki voltaj
Tasarıma bağlı olarak, tek bir kaynak sadece belirli bir potansiyel fark yaratabilir. Elektrikli cihazlarda kullanım için piller halinde birleştirilirler.
2. Özgül kapasite
Belirli bir süre (saat olarak) bir kimyasal akım kaynağı, bir ağırlık veya hacim birimine atfedilen sınırlı miktarda akım (amper cinsinden) üretebilir.
3. Güç yoğunluğu
Bir kimyasal akım kaynağının ağırlık biriminin veya hacminin, voltajın akım gücü ile ürettiği gücü üretme kabiliyetini karakterize eder.
4. Çalışma süresi
Bu parametreye son kullanma tarihi de denir.
5. kendi kendine deşarj akımları değeri
Elektrokimyasal reaksiyonların bu yan işlemleri, elementlerin aktif kütlesinin tüketimine yol açar, korozyona neden olur ve spesifik kapasiteyi azaltır.
6. Ürün fiyatı
Tasarıma, kullanılan malzemelere ve bir dizi başka faktöre bağlıdır.
En iyi kimyasal akım kaynakları, ilk dört parametrenin yüksek değerlerine sahip olanlardır ve kendi kendine deşarj ve maliyet düşüktür.
Akü Şarj İlkeleri
Sekonder kimyasal akım kaynakları arasında büyük popülerlik kazanıyorlar. lityum iyon modelleri, elektronik cihazlara güç sağlamak için yaygın olarak kullanılmaktadır. Pozitif elektrodun malzemesi olarak LiMO2 (M Co, Ni, Mn) ve negatif elektrot olarak grafit kullanırlar.
Yüklendiğinde, uygulanan harici enerjiden gelen lityum iyonları katot metalinden salınır, elektrolitten geçer ve orada biriken grafit katmanları arasındaki boşluğa nüfuz eder.
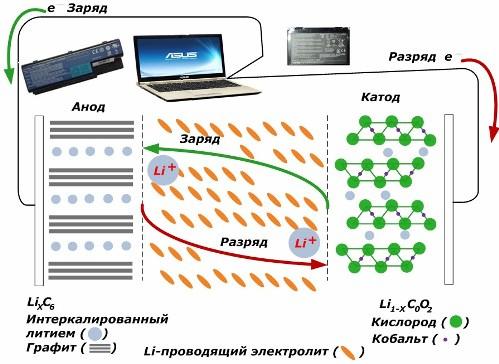
Enerji şarj yük yoktur ve yük elektrotlara bağlanır, daha sonra elektrolitteki lityum iyonları ters yönde hareket eder.
Şarj ve deşarj yapılmazsa, bataryadaki enerji tüketilmez, depolanır. Ancak miktarı kullanılan malzemelerin özellikleri ile sınırlıdır. Örneğin, lityum iyon pillerde, belirli elektrik kapasitesi 130 ÷ 150 mAh / g'dır. Anot malzemesinin özellikleri ile sınırlıdır. Grafit için kapasite yaklaşık iki kat daha yüksektir.
Bilim adamları şimdi pil kapasitesini artırmanın yollarını arıyorlar, havadaki lityum ve oksijen arasında kimyasal reaksiyon kullanma olasılığını araştırıyorlar. Bunu yapmak için, tasarımlar ayrı pillerde kullanılan hava, gider edilemez bir katot ile geliştirilir. Bu yöntem enerji yoğunluğunu 10 kata kadar artırabilir.
Kimyasal akım kaynaklarının çalışması bilgi gerektirir elektrik mühendisliğinin temelleri, elektrokimya, malzeme bilimi ve katıhal fiziği.
Ayrıca bkz. electro-tr.tomathouse.com
:
