kategoriler: Acemi elektrikçiler, Endüstriyel elektrikçi
Görüntülenme sayısı: 37528
Makaleye Yorumlar: 0
Elektrolizin pratik uygulaması
Bir elektrik akımı bir çözeltiden veya bir eriyik elektrolitten geçtiğinde, elektrotlar üzerinde ikincil reaksiyonların ürünü olan çözünenler veya diğer maddeler elektrotlar üzerinde salınır. Bu fizikokimyasal işleme elektroliz denir.
Elektrolizin özü
Elektrotlar tarafından oluşturulan elektrik alanında, iletken sıvıdaki iyonlar düzenli bir hareketle gelir. Negatif elektrot katot, pozitif anottur.
Anyon olarak adlandırılan negatif iyonlar (hidroksil grubunun iyonları ve asit kalıntıları) anoduna, katyon adı verilen pozitif iyonlar (hidrojen, metal, amonyum iyonları, vb.) Katoda koşar
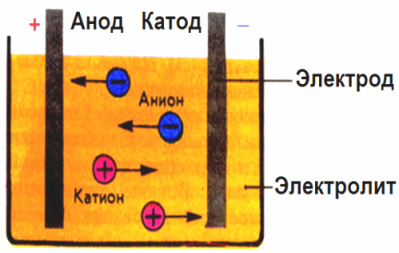
Elektrotlarda bir oksidasyon-indirgeme işlemi gerçekleşir: katotta partiküllerin (atomlar, moleküller, katyonlar) elektrokimyasal indirgenmesi ve anotta partiküllerin (atomlar, moleküller, anyonlar) elektrokimyasal oksidasyonu meydana gelir. Bir elektrolitteki ayrışma reaksiyonları birincil reaksiyonlardır ve doğrudan elektrotlarda ilerleyen reaksiyonlara sekonder denir.
Faraday elektroliz yasaları
Elektroliz reaksiyonlarının birincil ve ikincil olarak ayrılması, Michael Faraday'ın elektroliz yasalarını oluşturmasına yardımcı oldu:
-
Faraday elektrolizinin birinci yasası: elektroliz sırasında elektrot üzerinde biriken maddenin kütlesi, bu elektrota aktarılan elektrik miktarı ile doğru orantılıdır. Elektrik miktarı, kural olarak, kolyelerde ölçülen bir elektrik yükü anlamına gelir.
-
Faraday elektrolizinin ikinci yasası: belirli bir elektrik miktarı (elektrik yükü) için, elektrot üzerinde biriken kimyasal elementin kütlesi, elementin eşdeğer kütlesi ile doğru orantılıdır. Bir maddenin eşdeğer kütlesi, maddenin katıldığı kimyasal reaksiyona bağlı olarak molar kütlesinin bir tam sayıya bölünmesidir.
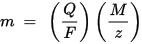
m, elektrotta biriken maddenin kütlesidir, Q, F = 96,485.33 (83) C mol - 1 maddesinden geçen toplam elektrik yüküdür. / mol), z bir maddenin iyonlarının değerlik sayısıdır (iyon başına elektron sayısı).
M / z'nin çökelen maddenin eşdeğer kütlesi olduğuna dikkat edin. İlk Faraday yasası için M, F ve z sabitlerdir, bu nedenle Q değeri ne kadar büyük olursa, m değeri de o kadar büyük olur. İkinci Faraday yasası için, Q, F ve z sabitlerdir, bu nedenle M / z (eşdeğer kütle) değeri ne kadar büyük olursa, m değeri de o kadar büyük olur.
Elektroliz günümüzde endüstride ve teknolojide yaygın olarak kullanılmaktadır. Örneğin, hidrojen, hidrojen peroksit, manganez dioksit, alüminyum, sodyum, magnezyum, kalsiyum ve diğer maddelerin endüstriyel üretimi için en verimli yöntemlerden biri olarak hizmet eden elektrolizdir. Elektroliz, atık suyu arıtmak için, elektrokaplamada, elektrokaplamada ve son olarak kimyasal akım kaynaklarında kullanılır. Ama önce ilk şeyler.
Elektroliz ile cevherlerden saf metal elde etme
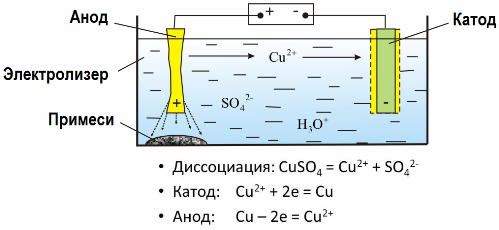
Elektroliz sayesinde, birçok metal cevherlerden ekstrakte edilir ve daha ileri işlemlere tabi tutulur. Bu nedenle, cevher veya zenginleştirilmiş cevher konsantresi - reaktiflerle işlendiğinde, metal çözeltiye geçer, daha sonra metal elektro-ekstraksiyon ile çözeltiden çıkarılır. Saf metal aynı zamanda katotta salınır. Bu şekilde çinko, bakır, kadmiyum alırlar.
Metaller, safsızlıkları gidermek ve içerdiği safsızlıkları daha ileri işlem için uygun bir forma dönüştürmek için elektro-rafine edilir. Temizlenecek metal plakalar şeklinde dökülür ve bu plakalar elektrolizde anot olarak kullanılır.
Akım geçtiğinde, anodun metali çözülür, katyonlar halinde çözeltiye geçer, daha sonra katyonlar katotta boşaltılır ve saf metalin bir çökeltisini oluşturur. Anodun safsızlıkları çözülmez - anot bulamacı ile çökelir veya sürekli veya periyodik olarak çıkarıldıkları yerden elektrolite geçer.
Örnek olarak düşünün bakır elektro rafine etme. Çözeltinin ana bileşeni - bakır sülfat - bu metalin en yaygın ve en ucuz tuzu. Çözelti düşük bir elektrik iletkenliğine sahiptir. Artırmak için elektrolite sülfürik asit eklenir.
Ek olarak, kompakt metal çökeltisinin oluşumunu kolaylaştırmak için çözeltiye küçük miktarlarda katkı maddesi eklenir. Genel olarak bakır, nikel, kurşun, kalay, gümüş ve altın elektrolitik rafine işlemine tabi tutulur.
Elektroliz Atıksu Arıtımı
Atık su arıtımında elektroliz kullanılır (elektrokoagülasyon, elektroekstraksiyon ve elektroflotasyon süreçleri). Elektrokimyasal temizleme yöntemi en yaygın kullanılan yöntemlerden biridir. Elektroliz için çözünmeyen anotlar (manyetit, kurşun oksit, grafit, bir titanyum bazında biriken manganez) veya çözünür (alüminyum, demir) kullanılır.
Bu yöntem toksik organik ve inorganik maddeleri sudan izole etmek için kullanılır. Örneğin, bakır borular bir sülfürik asit çözeltisi ile kireçten arındırılır ve daha sonra endüstriyel atık su, çözünmeyen bir anotla elektroliz ile temizlenmelidir. Bakır, aynı kuruluşta tekrar kullanılabilen katoda salınır.
Alkali atık su, siyanür bileşiklerinden elektroliz ile arıtılır. Siyanürlerin oksidasyonunu hızlandırmak, elektrik iletkenliğini arttırmak ve enerji tasarrufu sağlamak için suda sodyum klorür formunda bir katkı maddesi kullanılır.
Elektroliz, bir grafit anot ve bir çelik katot ile gerçekleştirilir. Siyanürler, anot üzerinde salınan elektrokimyasal oksidasyon ve klor sırasında yok edilir. Bu temizliğin etkinliği% 100'e yakındır.
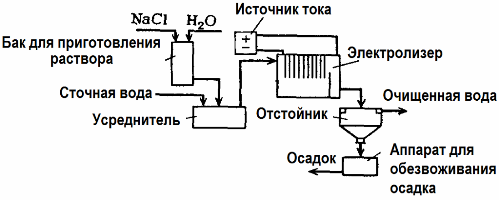
Doğrudan elektrokimyasal temizlemeye ek olarak, elektroliz işlemine dahil edilebilir pıhtılaşma. Tuzların eklenmesi hariç, elektroliz çözünür alüminyum veya demir anotlar ile gerçekleştirilir. Daha sonra sadece anot üzerindeki kirleticiler yok edilmez, aynı zamanda anodun kendisi de çözülür. Kolloidal dağılmış kontaminantları pıhtılaştıran (kalınlaştıran) aktif dağılmış bileşikler oluşur.
Bu yöntem katı yağlar, sıvı yağlar, boyalar, sıvı yağlar, radyoaktif maddeler vb. Atık suların arıtımında etkilidir. Elektrokoagülasyon denir.
galvanizleme
Elektrokaplama, ürünleri korozyondan korumak ve onlara uygun bir estetik görünüm vermek için belirli metallerin elektrolitik birikimidir (kaplama krom, nikel, gümüş, altın, platin vb. İle yapılır). Şey, iyice temizlenir, yağdan arındırılır ve ürüne kaplanması gereken metalin tuz çözeltisinin döküldüğü bir elektrolitik banyoda bir katot olarak kullanılır.
Anot olarak aynı metalden bir plaka kullanılır. Kural olarak, bir çift anot plakası kullanılır ve galvanizlenecek konu aralarına yerleştirilir.
galvanoplastikler
Elektrokaplama - şekillerinin yeniden üretilmesi için farklı cisimlerin yüzeyinde metal birikimi: parçalar, heykeller, baskılı klişeler vb.

Metalin bir nesnenin yüzeyinde galvanik birikmesi sadece bu yüzey veya tüm nesne bir elektrik akımı iletkeni olduğunda mümkündür, bu nedenle model veya form yapmak için metallerin kullanılması tavsiye edilir. Eriyebilir metaller bu amaç için en uygun olanlardır: kurşun, kalay, lehimler, Ahşap alaşımı.
Bu metaller yumuşaktır, metal işleme aletleriyle kolayca işlenir, iyi kazınmış ve dökülmüştür. Galvanik tabakayı oluşturduktan ve bitirdikten sonra kalıp metali bitmiş üründen eritilir.
Bununla birlikte, modellerin üretimi için en büyük fırsatlar hala dielektrik malzemelerle temsil edilmektedir. Bu modelleri metalize etmek için yüzeylerine elektrik iletkenliği vermek gerekir. Başarı veya başarısızlık sonuçta esas olarak iletken tabakanın kalitesine bağlıdır. Bu katman üç yoldan biriyle uygulanabilir.
En yaygın yol grafitirovanie, hamuru ve grafitin yüzeyde taşlanmasını sağlayan diğer malzemeler için uygundur.
Bir sonraki numara bronzlama, yöntem nispeten karmaşık şekilli modeller için iyidir, farklı malzemeler için, ancak bronz tabakanın kalınlığı nedeniyle, küçük detayların transferi biraz bozulur.
Ve sonunda gümüşlenmeher durumda uygundur, ancak özellikle çok karmaşık bir şekle sahip olan kırılgan modeller için vazgeçilmezdir - bitkiler, böcekler, vb.
Kimyasal akım kaynakları
Ayrıca, elektroliz, piller ve akümülatörler gibi en modern kimyasal akım kaynaklarının çalıştığı ana süreçtir. Elektrolit ile temas eden iki elektrot vardır.
Elektrotlar arasında potansiyel bir fark vardır - redoks reaksiyonunun serbest enerjisine karşılık gelen bir elektromotor kuvvet. Daha fazla ayrıntı için buraya bakın: Elektrik akımının kimyasal kaynakları
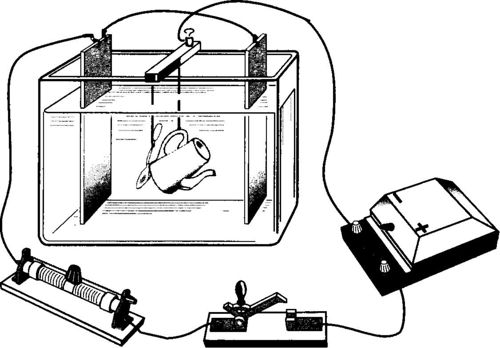
Limon pili (büyütmek için resmin üzerine tıklayın)
Kimyasal akım kaynaklarının etkisi, kapalı bir harici devre ile uzamsal olarak ayrılmış işlemlerin ortaya çıkmasına dayanır: negatif anot üzerinde indirgeyici ajan oksitlenir, oluşan serbest elektronlar dış devreden pozitif katoda geçer, oksidasyon azaltma reaksiyonuna katıldıkları yerde bir deşarj akımı oluştururlar. Böylece, harici devre boyunca negatif yüklü elektronların akışı anottan katoda, yani negatif elektrottan pozitif olana gider.
Ayrıca bkz. electro-tr.tomathouse.com
: