kategoriler: Öne Çıkan Makaleler » Acemi elektrikçiler
Görüntülenme sayısı: 70526
Makaleye Yorumlar: 0
Galvanik hücreler - cihaz, çalışma prensibi, çeşitleri ve ana özellikleri
Galvanik hücrelerin ortaya çıkması için önkoşullar. Biraz tarih. 1786'da İtalyan tıp profesörü, fizyolog Luigi Aloisio Galvani ilginç bir fenomen keşfetti: bilim adamı çelik bir neşterle dokunduğunda bakır kancalar üzerinde asılı duran bir kurbağanın yeni açılan bir cesedinin arka bacaklarının kasları. Galvani derhal bunun "hayvan elektriğinin" bir tezahürü olduğu sonucuna vardı.
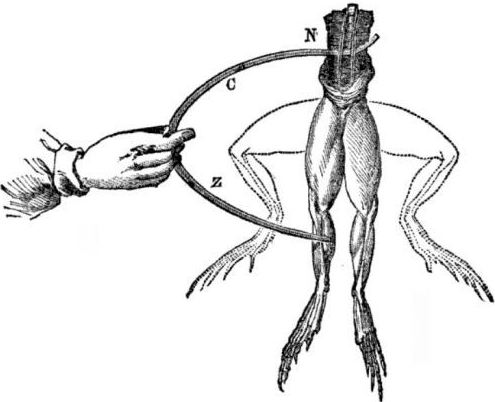
Galvani'nin ölümünden sonra, kimyager ve fizikçi olarak çağdaş Alessandro Volta, farklı metaller temas ettiğinde elektrik akımının ortaya çıkması için daha gerçekçi bir mekanizma tanımlayacak ve halka açık bir şekilde gösterecektir.
Volta, bir dizi deneyden sonra, bir sıvının içine yerleştirilen farklı metallerin iki iletkeninin varlığından dolayı akımda devrede göründüğü kesin bir sonuca varacak ve Galvani'nin düşündüğü gibi bu hiç de “hayvan elektriği” değil. Kurbağa bacaklarının seğirmesi, çeşitli metallerin (bakır kancalar ve çelik bir neşter) temasından kaynaklanan akımın etkisinin bir sonucuydu.
Volta, Galvani'nin ölü bir kurbağada gösterdiği aynı fenomeni gösterecek, ancak tamamen cansız bir ev yapımı elektrometrede gösterilecek ve 1800'de akımın doğru bir açıklamasını verecektir: “ikinci sınıf iletken (sıvı) ortada ve iki farklı birinci sınıf iletkenle temas halindedir metaller ... Bunun sonucunda bir yönde veya başka bir yönde elektrik akımı ortaya çıkıyor. ”

İlk deneylerden birinde, Volta iki tabak - çinko ve bakır - bir asit kavanozuna indirdi ve bunları tel ile bağladı. Bundan sonra, çinko levha çözünmeye başladı ve bakır çelik üzerinde gaz kabarcıkları oluştu. Volta, elektrik akımının telden aktığını önerdi ve kanıtladı.
Böylece ilk galvanik hücre olan "Volta elementi" icat edildi. Rahatlık için Volta, birbirine bağlı çinko, bakır halkaları ve asitle emprenye edilmiş kumaştan oluşan dikey bir silindir (sütun) şekli verdi. Yarım metre yüksekliğinde bir volt kutbu insanlara karşı hassas bir voltaj yarattı.
Araştırmanın başlangıcından beri adı Luigi Galvani, kimyasal akım kaynağı onun adına anısını korudu.
Galvanik hücre Kapalı bir devrede elektrik akımının ortaya çıkmasına yol açan iki metalin ve / veya oksitlerinin bir elektrolitteki etkileşimine dayanan kimyasal bir elektrik akımı kaynağıdır. Böylece galvanik hücrelerde kimyasal enerji elektrik enerjisine dönüştürülür.
Bugün Hücreler

Bugün hücrelere pil denir. Üç tip pil yaygındır: salin (kuru), alkalin (ayrıca alkalin, İngilizce'den çeviri için "alkalin" - "alkalin") ve lityum. Çalışmalarının prensibi, 1800'de Volta tarafından tarif edilenle aynıdır: iki metal elektrolit yoluyla etkileşimve harici bir kapalı devrede bir elektrik akımı ortaya çıkar.
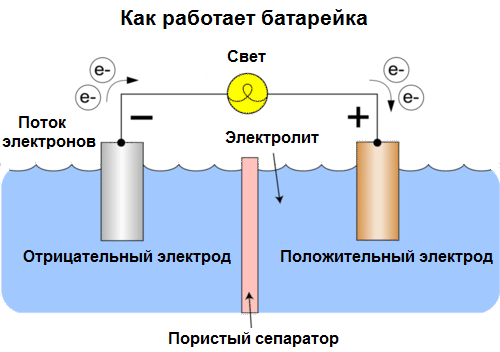
Akü voltajı kullanılan metallere ve "akü" deki hücre sayısına bağlıdır. Piller, pillerden farklı olarak, kimyasal enerjiyi, yani pili oluşturan reaktiflerin (indirgeyici ve oksitleyici) enerjisini doğrudan elektrik enerjisine dönüştürdüğü için özelliklerini geri yükleyemezler.
Bataryaya dahil edilen reaktifler çalışması sırasında tüketilir, akım yavaş yavaş azalır, böylece reaktifler tamamen reaksiyona girdikten sonra kaynağın etkisi sona erer.
Alkalin ve tuz elementleri (piller), çeşitli elektronik cihazlara, radyo cihazlarına, oyuncaklara ve lityuma güç sağlamak için yaygın olarak kullanılır, çoğunlukla kan şekeri ölçüm cihazları gibi taşınabilir tıbbi cihazlarda veya kameralar gibi dijital teknolojide bulunur.

Tuz pilleri
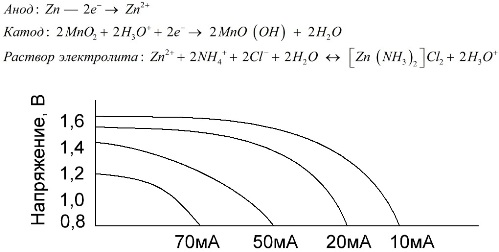
Tuz pilleri olarak adlandırılan manganez-çinko hücreler, içinde sıvı elektrolit çözeltisi bulunmayan “kuru” galvanik hücrelerdir.
Bir çinko elektrot (+) fincan şeklinde bir katottur ve mangan dioksit ve grafitin toz halinde bir karışımı anot olarak işlev görür. Akım bir grafit çubuktan akar. Bir elektrolit olarak, bir amonyum klorür çözeltisinden kalınlaştırmak için nişasta veya un ilavesiyle bir macun kullanılır, böylece hiçbir şey akmaz.
Tipik olarak, pil üreticileri tuz elemanlarının tam bileşimini belirtmez, ancak tuz pilleri en ucuz olanıdır, genellikle güç tüketiminin son derece düşük olduğu cihazlarda kullanılır: saatlerde, uzaktan kumandalarda, elektronik termometrelerde vb.

"Nominal kapasite" kavramı nadiren manganez-çinko pilleri karakterize etmek için kullanılır, çünkü kapasiteleri büyük ölçüde çalışma koşullarına ve koşullarına bağlıdır. Bu elemanların ana dezavantajları, deşarj boyunca önemli bir voltaj azaltma oranı ve artan deşarj akımı ile çıkış kapasitansında önemli bir azalmadır. Nihai deşarj gerilimi 0,7-1,0 V aralığındaki yüke bağlı olarak ayarlanır.
Sadece deşarj akımının büyüklüğü değil, aynı zamanda yükün zaman çizelgesi de önemlidir. Büyük ve orta akımların aralıklı deşarjları ile, pillerin performansı sürekli çalışmaya kıyasla belirgin şekilde artar. Bununla birlikte, küçük deşarj akımları ve çalışma sırasında aylarca kesinti olması durumunda, kendi kendine deşarj sonucu kapasitansları azalabilir.
Yukarıdaki grafik, daha sonra tartışılacak olan bir alkalinle karşılaştırmak için ortalama 4, 10, 20 ve 40 saatlik bir tuz aküsü için deşarj eğrilerini göstermektedir.
Alkalin (alkalin) piller
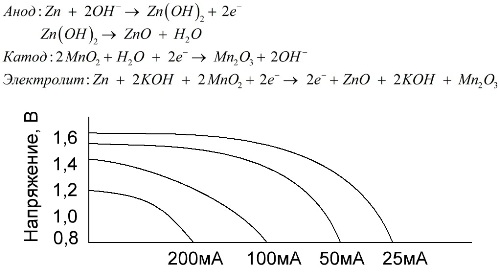
Bir alkalin pil, manganez dioksitin bir katot olarak kullanıldığı, toz haline getirilmiş çinko anot olarak kullanıldığı ve bir alkali çözeltisinin, genellikle bir potasyum hidroksit macunu biçiminde bir elektrolit olarak kullanıldığı bir manganez-çinko galvanik pildir.
Bu pillerin bir dizi avantajı vardır (özellikle, önemli ölçüde daha büyük bir kapasite, düşük sıcaklıklarda daha iyi performans ve yüksek yük akımları).

Alkalin piller, salin ile karşılaştırıldığında, uzun süre daha fazla akım sağlayabilir. Daha büyük bir akım mümkün olur çünkü çinko burada bir cam formunda değil, elektrolit ile daha geniş bir temas alanına sahip bir toz formunda kullanılır. Bir macun formundaki potasyum hidroksit, elektrolit olarak kullanılır.
Bu tip galvanik hücrelerin uzun süre önemli bir akım (1 A'ya kadar) sunma kabiliyeti sayesinde, alkalin piller şu anda en yaygın olanıdır.
Elektrikli oyuncaklarda, taşınabilir tıbbi ekipmanlarda, elektronik cihazlarda, kameralarda, alkalin piller her yerde kullanılır. Deşarj düşük akımsa tuzdan 1.5 kat daha uzun süre hizmet ederler. Grafik, 4, 10, 20 ve 40 saat boyunca bir tuz pili (grafik yukarıda verilmiştir) ile karşılaştırmak için farklı akımlarda deşarj eğrilerini göstermektedir.
Lityum piller
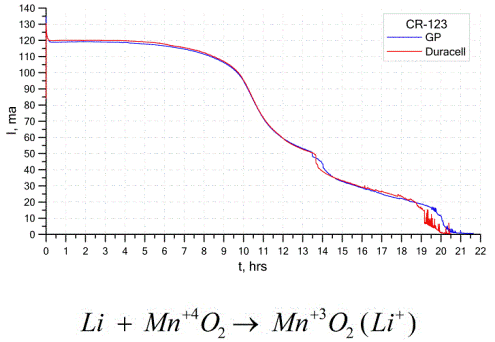
Oldukça yaygın bir başka galvanik hücre tipi, lityum pillerdir - lityumun veya bileşiklerinin anot olarak kullanıldığı, şarj edilemeyen tek galvanik hücreler. Alkali metal kullanımı nedeniyle, yüksek potansiyel farkına sahiptirler.

Bir lityum hücresinin katodu ve elektroliti çok farklı olabilir, bu nedenle "lityum hücresi" terimi bir grup hücreyi aynı anot materyali ile birleştirir.Bir katot olarak, örneğin, manganez dioksit, karbon monoflorür, pirit, tiyonil klorür, vb. Kullanılabilir.
Lityum piller, yüksek çalışma süreleri ve yüksek maliyetleriyle diğer pillerden ayırt edilir. Seçilen boyuta ve kullanılan kimyasal maddelere bağlı olarak, bir lityum pil 1,5 V (alkalin pillerle uyumlu) ila 3,7 V arasında voltaj üretebilir.
Bu piller birim kütle başına en yüksek kapasiteye ve uzun raf ömrüne sahiptir. Lityum hücreler modern taşınabilir elektronik ekipmanlarda yaygın olarak kullanılır: bilgisayar anakartlarındaki saatlere güç sağlamak için, taşınabilir tıbbi cihazlara, saatlere, hesap makinelerine, fotoğraf ekipmanlarında vb.
Yukarıdaki grafik, iki popüler üreticinin iki lityum pili için deşarj eğrilerini göstermektedir. Başlangıç akımı 120 mA idi (24 Ohm mertebesinde direnç başına).
Ayrıca bakınız: Modern şarj edilebilir piller - avantajları ve dezavantajları
Ayrıca bkz. electro-tr.tomathouse.com
: